Proteasomen (EC: 3.4.99.46) sind die zentralen Enzyme des nicht-lysosomalen Proteinabbaus in Zellen höherer Organismen (ATP-abhängiger Ubiquitin-Konjugat-Weg). Sie spielen eine Rolle beim Abbau von falsch gefalteten und von kurzlebigen Proteinen. In Pflanzen und Tieren sind sie hierüber an der Regulation des Zellzyklus beteiligt. In Pflanzen sind sie an der Abwehr von Infektionen beteiligt (Tabak/TMV). In Tieren erzeugen sie die Peptide, die durch den major histocompatibility complex I dem Immunsystem zur Induktion von Antikörpern präsentiert werden. Der größte Teil der Peptide hat eine Länge von sechs bis neun Aminosäuren.

Der aktive Teil eines Proteasomes sedimentiert mit 20S. Er besteht aus vier gestapelten
Ringen von je sieben Untereinheiten. Die inneren beiden Ringe (weiß) enthalten
Untereinheiten
vom Typ beta, diese tragen die katalytische Funktion. Die Proteine werden als inaktive
Precursor synthetisiert, erst beim Zusammenbau des Proteasoms wird das Propeptid
abgespalten und die aktive Aminosäure (Threonin) sterisch zugänglich.
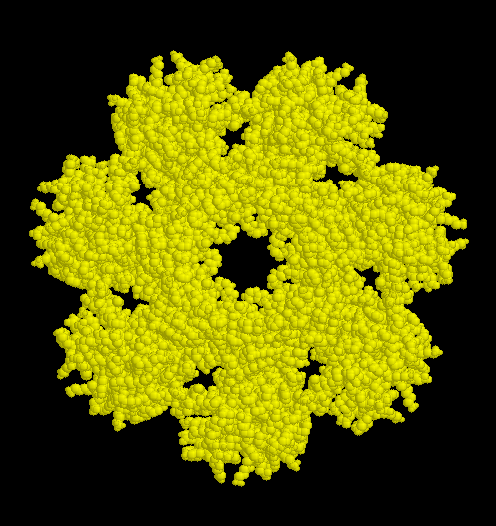
Die beiden äußeren Ringe mit Proteinen vom
Typ alpha haben regulierende Funktionen (rechts Aufsicht auf einen alpha-Ring). Die
Proteine organisieren sich spontan zu den Ringen und sorgen dann für die Anlagerung
der beta-Untereinheiten.
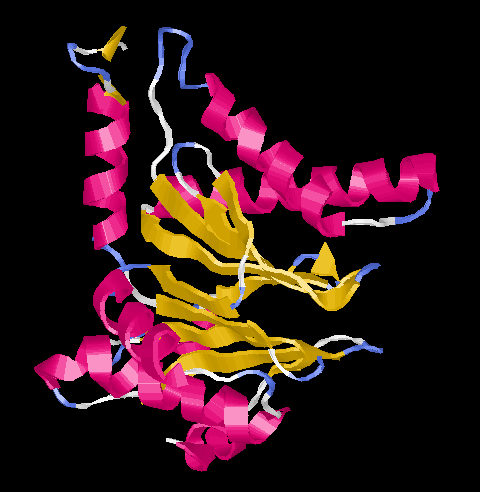
Alle Untereinheiten haben das gleiche
Faltungsmuster (Ntn = N-terminal nucleophile), das auch in drei anderen nicht so
komplex organisierten Enzymen gefunden wurde. Zentral befinden sich zwei fünfsträngige
antiparallele Faltblätter, die von alpha-Helices umgeben sind.
Der Zylinder aus den vier alpha- und beta-Ringen ist an seinen Enden in Eukaryoten mit Proteinkomplexen assoziiert, die mit 19S sedimentieren. Sie enthalten u.a. ATPasen, die die zu verdauenden Proteine für die Aktivität des Proteasoms vorbereiten (entfalten). Diese "großen" Proteasomen werden als 26S-Proteasomen bezeichnet. Sie kommen im Cytosol und in den Kernen aller untersuchten Zellen vor.
In dem Archaebacterium Thermoplasma acidophilum kommt ein 20S-Proteasom vor, das aus je 14 identischen alpha- und beta-Untereinheiten zusammengesetzt ist. Es bildet einen Zylinder von 11 nm Durchmesser und 15 nm Höhe. Seine Struktur konnte durch Röntgenbeugung aufgeklärt werden und wird im Folgenden erläutert.