sterile Lanzettnadel
absouter Alkohol
Watte
Dokumentationskarte
3 Glasstäbe
Schellack
Pasteurpipetten mit Hütchen
anti - BSA (Antiserum gegen Rinderserumalbumin, hergestellt in Kaninchen)
BSA- Lösung (20 mg / ml)
Hühneralbumin- Lösung (20 mg / ml)
Gestell mit 10 Zentrifugengläsern
Gestell mit 20 Reagenzgläsern
Pipetten :
20 á 0,1 ml
20 á 1.0 ml
20 á 10 ml
100 ml phosphatgepufferte, physiologische Kochsalzlösung (PBS: phosphor buffered saline ) = 0,9 %ige NaCl Lösung in 0,1 m Phosphatpuffer, pH 7.0 )
n / 50 NaOH
Papierhandtücher
Folin - Ciocalteusches Reagenz (1 : 3 verdünnt): hergestellt nach folgender Vorschrift:
100 g NaWO4 x 2 H2O ; 25 g NaMoO4 x 2H2O ; 700 ml H2O; 50 ml 85%ige H3PO4 und 100 ml conz. HCl. - für 10 Stunden unter Rückfluß kochen, dann 150 g Li2SO4, 50 ml H20 und einige Tropfen Brom hinzugeben, dann wieder 15 min. kochen, abkühlen lassen, auf 1 l auffüllen, filtrieren - in dunkler Flasche aufheben - fertig ! Man kann das Reagenz aber auch schon fertig kaufen.
12,5 %ige Lösung von Na2CO3 (Anhydrid)
0,1 %ige CuSO4 Lösung
Objektträger mit Agar beschichtet1,5 g Agar wurden 30 min. in 1 : 1 verdünntem Veronalpuffer gekocht [Veronalpuffer : 0,05 m Veronal - Na (8,5 g / l ) ; pH 8 ; mit 1 n HCl eingestellt], 0,01 % Merthiolat wurden zugesetzt. 2 ml pro Objektträger.
In die erstarrten Proben wurden Löcher gestanzt. Die Objektträger werden in Petrischalen aufgehoben, in denen ein angefeuchtetes Filterpapier liegt, um zu verhindern, daß die Agarschicht austrocknet Die Platten wurden erst wenige Stunden vor Praktikumsbeginn hergestellt.
Antiseren
Anti A
Anti B
Anti A + BWasserbäder, eingestellt auf 37° C
Zentrifugen
Spektralphotometer, eingestellt auf lambda = 750 nm
Brutschrank, eingestellt auf 37°C
Feuchthaltekammern (Frühstücksbehälter)
| VORSICHT | |
|---|---|
| In diesem Experiment wird mit gefährlichen
Chemikalien umgegangen:
Ethanol ist leichtentzündlich. Behälter dicht geschlossen
halten. Von Zündquellen fernhalten - nicht rauchen. |
Die Bildung von Antikörpern kann durch Infektion einer Fremdkörpersuspension (eines Antigens) induziert werden. Die gebildeten Antikörper sind spezifisch, d.h. sie reagieren nur mit dem homologen Antigen, dem gleichen, durch das ihre Bildung induziert wurde, oder mit sehr ähnlichen Antigenen (heterologe Antigene). Antikörper sind Eiweißmoleküle, die (vorwiegend) gelöst im Blutplasma vorkommen. Man rechnet sie zu einer bestimmten Bluteiweißfraktion, den gamma-Globulinen (oder Imunglobulinen). Immunglobuline bilden eine heterogene Molekülpopulation , d. h. alle Moleküle zeigen untereinander eine Reihe von Gemeinsamkeiten und Unterschieden.
Die Substanzen, die wir bisher kennengelernt haben, wie die beta -
Galactosidase, Amylase, NaCl, H2O u.s.w. bestehen aus Molekülen,
die untereinander alle gleich sind, es sind also homogene Molekülpopulationen.
Wir haben im Praktikum nicht genügend Zeit, um Tiere zu immunisieren
und so die Bildung spezifischer Antikörper zu induzieren. Sie erhalten
von uns deshalb Serum eines Kaninchens, welchem vorher ein Antigen injiziert
worden ist.
Sicher haben Sie eine solche Impfung (Immunisierung selbst auch bereits
hinter sich:
![]() Pockenschutzimpfung
Pockenschutzimpfung
![]() Polio - Schutzimpfung (Schluckimpfung).
Polio - Schutzimpfung (Schluckimpfung).
Der Körper bildet innerhalb weniger Tage (14 - 21) die spezifischen
Antikörper. Ein Serum, welches sie enthält, heißt Antiserum.
Die Menge an Antiserum im Serum wird als Antikörpertiter bezeichnet.
Die Antikörper gehören einer bestimmten Blutplasmaproteinklasse,
den gamma-Globulinen an. Blutplasmaproteine
lassen sich leicht elektrophoretisch auftrennen. Die Hauptmasse bilden
die Albumine
Was Sie an dieser Stelle noch wissen sollten: der Titer in Ihrem Blutserum
z. B. von Antikörpern gegen Pockenviren ist sehr wahrscheinlich vernachlässigbar
niedrig. Durch eine Untersuchung des Serums zum heutigen Zeitpunkt wäre
es ausgeschlossen, zu entscheiden, ob Sie bereits imunisiert worden sind
oder nicht. Trotzdem hat sich bei der ersten Immunisierung soetwas wie
ein Immunologisches Gedächtnis etabliert, Sobald Sie nämlich
ein zweites Mal (zufällig oder nicht) mit dem Antigen in Kontakt kommen,
werden unmittelbar danach (also nicht erst nach einer lag - Periode) große
Antikörpermengen gebildet und ins Blutserum abgegeben.
Es würde hier zu weit führen, etwas über den Mechanismus
der Antikörperbildung zu sagen. Sie sollten aber wissen, daß
sich die Vorgänge nicht nur auf rein molekularer Ebene abspielen,
sondern auch auf zellulären. Das Kaninchenserum, welches Sie im Kurs
erhalten werden, ist mit Rinderserumalbumin (BSA; da engl.: bovine serum
albumine) immunisiert worden. Das Serum wurde 3 Wochen nach der Injektion
des Antigens gewonnen. (Blutentnahme aus der Ohrvene). Das Serum wurde
duch Abzentrifugieren der Blutzellen gewonnen.
BSA haben wir für das heutige Experiment deshalb als Antigen gewählt,
weil es uns in reiner Form in größeren Mengen zur Verfügung
steht, weil man weiß, daß Kaninchen gut reagierende Antikörper
gegen dieses Antigen bilden und, was vielleicht das wichtigste ist, wir
kennen eine Reihe weiterer, sehr ähnlicher Albumine. z. B. das Ihnen
bereits bekannte Eialbumin. Wir können also prüfen, ob ein Antigen,
welches gegen Rinderserumalbumin gerichtet ist, auch mit einem ähnlichen
(= heterologen) Antigen wie Eialbumin, reagiert. Man weiß, daß
es derartige Kreuzreaktionen gibt. Denken Sie z.B. nur wieder an die Pockenschutzimpfung.
Menschen werden nicht mit den humanpathogenen Pockenviren immunisiert,
sondern mit den weit harmloseren Kuhpocken.
Ein Antigen kann mit dem Antikörper reagieren. Hierbei bildet sich
ein Antigen - Antikörperkomplex, welcher unter bestimmen Bedingungen,
die wir später noch untersuchen wollen, als schwerlösliches Präzipitat
ausfällt, weil die Moleküle ein umfangreiches Netzwerk bilden.
Man kann es abzentrifugieren und die Eiweißmenge bestimmen. Da man
vorher festlegen kann, wieviel Antigen man einsetzt, läßt sich
aus der Differenz unschwer die Menge präzipitierter Antikörper
bestimmen.
Die Problematik der Antikörperbildung und einen kurzen Abriß
über die Nachweisverfahren finden Sie in einem Aufsatz im Anhang
zu der Versuchsanleitung für diesen Nachmittag. Es ist dort auch beschrieben,
wie man zu klaren Ergebnissen kommt, wenn einem nur sehr kleine Mengen
an Antigen und Antikörper zur Verfügung stehen. Man arbeitet
in den Fällen mit einem Agargeldiffusionstest (nach seinem Erfinder
auch OUCHTERLONY - Test genannt). Wir werden mit diesem Test versuchen,
nachzuweisen, wie gut unser Antiserum mit heterologen Antigenen kreuzreagiert.
Wir werden versuchen, die Äquivalenzzone der Antikörper-Antigen-Reaktion
zu bestimmen, den Bereich also, bei dem wir die größte Präzipitatmenge
erhalten.
Bisher haben wir zum quantitativen Nachweis von Eiweiß nur mit
der Biuret - Reaktion gearbeitet (1.07 und 1.08). Diese Methode ist uns
heute nicht empfindlich genug. Sie erfaßt nicht mehr die geringen
Eiweißmengen, mit denen wir heute arbeiten werden.
Wir bedienen uns deshalb der viel empfindlicheren Folin Reaktion. (Die
Herstellungsvorschrift finden Sie im Methodenteil).
Schließlich sollen Sie heute auch Ihre eigene Blutgruppe bestimmen.
Wir stellen Ihnen Testseren zur Verfügung, die es erlauben, eine klare
Entscheidung zu treffen. Dieser Versuch hat in Praktika bisher immer zufriedenstellende
Ergebnisse gezeigt. Wir müssen Sie allerdings darauf hinweisen, daß
die Versuche ohne Aufsicht durch einen approbierten Arzt durchgeführt
werden. Die Ergebnisse sind somit im juristischen Sinne nicht verbindlich,
obwohl wir den Test genau so durchführen, wie in der Klinik und unsere
Seren von der gleichen Quelle stammen (Behring Werke, Marburg).
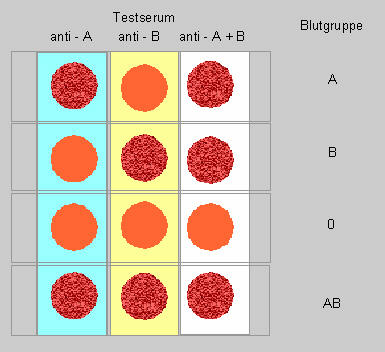
1. Sie brauchen einen Tropfen eigenes Blut: einer Fingerkuppe
entnehmen, eine sterile Lanzettnadel steht dazu zur Verfügung, Finger
vorher mit absolutem Alkohol abreiben.
2. Auf die Dokumentationskarte (oder einen Objektträger) je
einen Tropfen Antiserum
Anti A : blau
Anti B : gelb
Anti A+B : weiß
3. daneben je einen Tropfen Blut geben. (mit Pasteurpipette)
4. mit Glasstab verrühren (für jedes Serum einen neuen
verwenden). Die beiden Tropfen müssen eine homogene Suspension bilden.
5. Nach ca. 1 min. Ergebnis ablesen.
6. Nachdem die Proben vollständig eingetrocknet sind, können
Sie sie mit einem farblosen Lack (Schellack) bestreichen und somit konservieren.
Die Dokumentationskarte dürfen Sie behalten. (Wir können Ihnen
eine solche Karte demonstrieren, die vor 20 Jahren hergestellt wurde).
Ihnen steht ein verdünntes Kaninchen - anti - BSA -Serum zur Verfügung
und eine BSA - Lösung (20 mg / ml)
1. Setzen Sie 8 Röhrchen mit steigenden BSA - Mengen an. z.B:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8* |
| 0,1 ml | 0,5 ml | 1,0 ml | 2,0 ml | 4,0 ml |
* Da wir den Titer des Serums, mit dem Sie arbeiten werden, noch nicht kennen, betrachten Sie diese Werte nur als Richtwerte.
Genaue Angaben erfahren Sie während der Vorbesprechung.
Füllen Sie alle Röhrchen mit PBS auf 2.0 ml auf. (Vergessen Sie
den Blindwert nicht nur PBS ; Gläschen 9).
2. Geben Sie zu jedem der 9 Röhrchen 1 ml des verdünnten
Serums hinzu. Dann: Sie brauchen noch eine weitere Kontrolle: Gläschen
10: 2 ml BSA und 1 ml PBS, also Antigen ohne Antikörper.
3. Stellen Sie alle 10 Röhrchen für 30 min. ins Wasserbad.
4. Protokollieren Sie , in welchem Gläschen eine Trübung
auftritt und wie stark sie ist. ( - , + , ++ ....)
5. Zentrifugieren Sie die Präzipitate ab. (10 min. höchste
Drehzahl)
6. Sie sollen den Proteingehalt des Präzipitats (Sediments)
quantitativ bestimmen: Gießen Sie den Überstand vorsichtig ab.
Stellen Sie die Gläschen verkehrt herum für einen Moment auf
ein Papierhandtuch, um auch Reste der Flüssigkeit mit abzusaugen.
7. Eigentlich müßte man das Präzipitat waschen,
um wirklich exakte Ergebnisse zu erhalten (resuspendieren in PBS und nochmals
zentrifugieren), wir verzichten auf diesen Schritt. Das Präzipitat
wird in 2 ml n / 5ß NaOH gelöst.
8. Der Proteingehalt wird nach der Folin - Ciocalteu - Methode bestimmt:
Ansatz in Reagenzgläsern.
2 ml Probe
+ 6 ml Na2CO3 Lösung (12,5%ig)
+ 1 ml CuSO4 Lösung (0,1%ig )
60 min. stehenlassen (im Praktikum nur 30 min.), dann
1 ml Folin Reagenz hinzugeben
30 min. stehenlassen. Es bildet sich ein blauer Farbstoffkomplex. Für
eine Eichkurve der Folin - Reaktion folgende Standardlösungen einsetzen
Eialbumin :
0,01 mg / 2 ml
0,1 mg / 2 ml
1,0 mg / 2 ml
2,0 mg / 2 ml
4,0 mg / 2 ml
Stammlösung entsprechend verdünnen.
10. Extinktionen bei lambda = 750 nm messen. Ergebnisse graphisch
darstellen.
a ) Eichkurve
b ) Werte des Präzipitationstests
Sie erhalten Objektträger, die mit Agar beschichtet sind. In die Agarschicht sind 6 Löcher um ein zentrales Loch eingestanzt.
1. Geben Sie mit der Pasteurpipette einen Tropfen Antiserum in das
zentrale Loch. Füllen Sie drei Löcher mit BSA und zwar
Nr. 1: unverdünnt
Nr. 3: 1 : 10 verdünnt
Nr. 5: 1 : 100 verdünnt
Die Löcher 2, 4 und 6 werden mit Eialbuminlösung gefüllt,
ebenfalls verdünnt
Nr. 2: unverdünnt
Nr. 4: 1 : 10 verdünnt
Nr. 6: 1 : 100 verdünnt
2. Die 2. Platte wie folgt beschicken
| unverdünnt | ||
| 1 : 10 verdünnt | ||
| BSA | 1 : 100 verdünnt | |
| Eialbumin | 1 : 100 verdünnt | |
| Eialbumin | 1 : 10 verdünnt |
|
| Eialbumin | unverdünnt |
|
Stellen Sie die Proben in einer feuchten Kammer in den Brutschrank (37°C).
Die Auswertung erfolgt am folgenden Tage. Stellen Sie ein Diagramm her.
![]() Was können Sie aus den Ergebnissen schließen?
Was können Sie aus den Ergebnissen schließen?