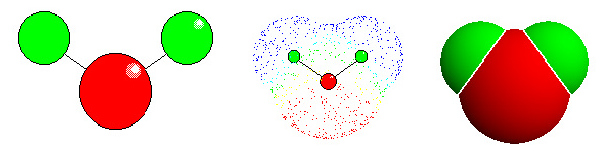
Wasser: links "ball-and stick"-Modell. Die Lage der Atome wird deutlich (rot: Sauerstoff, grün: Wassrstoff - in den meisten anderen Abbildungen in Botanik onlinewurde die Farbe türkis für Wasserstoff gewählt). Mitte: Elektronendichteverteilung. Die Elektronenwolken entsprechen den van der Waals Radien der einzelnen Atome. Für Wasserstoff beträgt der Radius 1,2 Å, für Sauerstoff 1,4 Å. Die Länge der kovalenten Bindung zwischen O und H beträgt 0,95 Å. Die ungleiche Ladungsverteilung bedingt ein Dipolmoment. Rechts: Kalottenmodell.