Seit der zweiten Hälfte des vorigen Jahrhunderts werden in der Mikroskopie Farbstoffe zum Nachweis bestimmter Stoffklassen verwendet. In den dreißiger Jahren dieses Jahrhunderts kamen Fluoreszenzfarbstoffe hinzu, die - in wesentlich niedrigeren Konzentrationen einsetzbar - auch als "Vitalfarbstoffe" Verwendung fanden.
Farbstoffmoleküle sind meist klein, und ihr Nachteil ist daher eine nur begrenzte Spezifität. Es gibt u.a. proteinspezifische Farbstoffe, doch kaum einen, der für ein bestimmtes Enzym spezifisch wäre. Die selektive Bindung wurde bei einigen Toxinen (z.B. Pilzgiften) nachgewiesen. Das Phalloidin (Toxin des Weißen Knollenblätterpilzes) bindet an Aktin. Durch Kopplung eines Fluoreszenzfarbstoffs an das Phalloidin läßt sich demnach Aktin in der Zelle lokalisieren.
Weit spezifischer sind die verschiedenen Makromoleküle und hier vor allem die Proteine:
Lektine: Im vorletzten Abschnitt haben wir die Lektine kennengelernt. Jedes kann mit einem Fluoreszenzmarker, wie Fluoroisothiocyanat (FITC: grüne Fluoreszenz) oder Rhodamin (rote Fluoreszenz) versehen werden. Solche Präparate werden in der medizinischen Forschung in großem Stil eingesetzt und sind daher relativ preiswert im Handel erhältlich. Sie eignen sich als Sonden zur Lokalisierung von Glykokonjugaten (=Lektinrezeptoren) an Zelloberflächen, an Membranoberflächen, in Kompartimenten u.a.
Makromoleküle haben den Nachteil, nicht ohne weiteres in Zellen eindringen zu können. Sie sind daher primär Marker extrazellulärer Oberflächenrezeptoren. Durch Cellulasebehandlung z.B. kann die Wand pflanzlicher Zellen abgebaut werden; es entstehen zellwandlose Protoplasten. Je nach Herkunft binden sie ConA oder RCA, was darauf hinweist, daß Glucose- oder Mannosereste, respektive Galactosereste an ihrer Oberfläche exponiert sind. Protoplastenpräparationen enthalten vielfach die unterschiedlichsten Zellfragmente, unter anderem auch freie Vakuolen. Die Vakuolenmembran, der Tonoplast, bindet keines der bekannten Lektine. Allein schon damit ist gezeigt, daß er chemisch anders aufgebaut ist als die Plasmamembran.
Fluoreszenzmarkierte Lektine eignen sich unter anderem zur Kartierung von Lektinrezeptoren in oder an Zellwänden, zum Nachweis einer Polarität von Zellen, zum Nachweis unterschiedlicher Aktivitätszustände oder bestimmter Stadien des Zellzyklus; sie eignen sich zur Messung der Löslichkeitseigenschaften der Lektinrezeptoren. WGA ist ein Indikator für Pilzmycelien in infiziertem pflanzlichem Gewebe.
Für elektronenmikroskopische Studien müssen die Lektine mit elektronendichten Markern (z.B. Ferritin oder kolloidalem Gold) gekoppelt werden. Mit diesen Komplexen lassen sich in entsprechend vorbereiteten Präparaten u.a. unterschiedliche Verteilungen an Membraninnen- und außenseiten erkennen. Lektine haben natürlich auch Nachteile:
- Ihre Bindungsorte sind die sogenannten Glykokonjugate. Es ist daher ohne Zusatzanalyse nicht möglich, zu entscheiden, ob z.B. ein ConA-Rezeptor ein Oligo- oder Polysaccharid, ein Glykoprotein oder ein Glykolipid ist.
- Lektine sind nur gegen ein sehr enges Spektrum an Zuckern gerichtet. Es gibt keine Lektine, um z.B. Arabinose- oder Xylosereste zu lokalisieren.
 Antikörper sind eine recht homogene Gruppe von Proteinen,
die im Serum von Vertebraten vorkommen und die den tierischen
Organismus vor Fremdeinflüssen, beispielsweise vor Infektionen
mit Bakterien und Viren oder vor eigenen Tumorzellen schützen
sollen. In Pflanzen kommen keine Antikörper vor. Da wir sie
aber zum Studium von Pflanzenzellen brauchen, hier zunächst
ein kurzes Porträt:
Antikörper sind eine recht homogene Gruppe von Proteinen,
die im Serum von Vertebraten vorkommen und die den tierischen
Organismus vor Fremdeinflüssen, beispielsweise vor Infektionen
mit Bakterien und Viren oder vor eigenen Tumorzellen schützen
sollen. In Pflanzen kommen keine Antikörper vor. Da wir sie
aber zum Studium von Pflanzenzellen brauchen, hier zunächst
ein kurzes Porträt:
Die Antikörperbildung ist induzierbar (Immunisierung). Das heißt, es wird ein Signal benötigt, das den tierischen Organismus zur Antikörperbildung stimuliert. Ein solches Signal muß stets makromolekular sein; es kann ein Bestandteil einer Zelloberfläche sein. Man bezeichnet solche Komponenten als Immunogene oder Antigene.
Ein Antigen ist meist größer als die Bindungsstelle
eines Antikörpers. Es kann daher mehrere (verschiedene) Antikörpermoleküle
binden. Der antikörperbindende Bereich des Antigens ist eine
antigene Determinante. Bei einer Immunisierung werden so viele
verschiedene Antikörper gebildet, wie es antigene Determinanten
gibt. Die Antikörperpopulation ist daher stets heterogen
oder, wie man heute sagt, polyklonal.
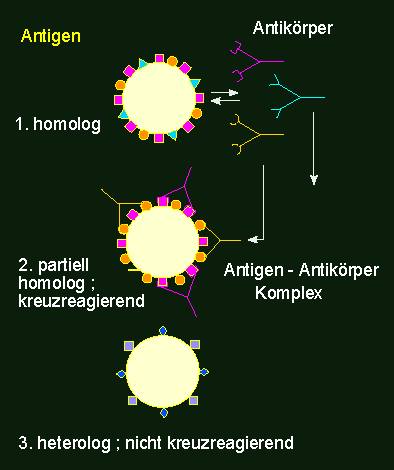
Antigen-Antikörperreaktion. Antikörper (Y-förmig dargestellt) stellen eine heterogene Molekülpopulation mit unterschiedlichen Spezifitäten dar. Eine Kreuzreaktion einer Antikörperpopulation (eines Antiserums) mit einem Fremdantigen (Mitte) erfolgt nur dann, wenn das homologe und das Fremdantigen zumindest partiell mit den gleichen Determinanten bestückt ist. Jedes Antikörpermolekül besitzt zwei gleiche Bindungsstellen für antigene Determinanten.
Um Antikörper mit einer bestimmten Spezifität zu erzeugen, immunisiert man üblicherweise Kaninchen. Zwei bis drei Wochen nach der Immunisierung kann ihnen Blut entnommen werden. Nach dem Abzentrifugieren der Blutzellen erhält man das sogenannte Antiserum mit den darin enthaltenen spezifischen Antikörpern. Sie eignen sich nunmehr zum qualitativen und quantitativen Nachweis des eingesetzten Antigens sowie zum Nachweis von Substanzen, die diesem Antigen ähnlich sind. Man spricht dabei von serologischer Kreuzreaktion oder serologischer Verwandtschaft. So findet man in der Regel eine mehr oder weniger stark ausgeprägte serologische Verwandtschaft zwischen homologen Proteinen (Enzymen, Speicherproteinen, dem Cytochrom c usw.), die man aus mehr oder weniger nah verwandten Tier- oder Pflanzenarten gewonnen hat. Der serologische Verwandtschaftsgrad ist hier meist mit der Zahl der Aminosäureunterschiede zwischen den Proteinen korreliert.
Es gibt eine Anzahl zum Teil sehr empfindlicher serologischer Nachweisverfahren, z.B. den Radioimmuntest (radio immuno assay: RIA).
Benötigt man einen Antikörper gegen ein kleikes Molekül, z.B. gegen ein Phytohormon, so muß man es als erstes an einen makromolekularen Träger koppeln; dadurch nimmt es die Eigenschaft einer antigenen Determinante an, und unter den zahlreichen, gegen diesen Komplex gebildeten Antikörpern sind auch solche, die gegen das Phytohormon gerichtet sind. Sie sind von den übrigen leicht abtrennbar, denn alle anderen reagieren mit dem Träger allein und können daher durch Präzipitation aus dem Serum entfernt werden. Übrig bleiben dann nur noch die hormonspezifischen Antikörper.
Zur Lokalisation von Antigenen in Zellen geht man den schon für Lektine beschriebenen Weg. Es ist jedoch nicht üblich, den Antikörper direkt mit einem Fluoreszenzmarker zu versehen, denn es ist viel vorteilhafter, in einem anderen Tier (z.B. in Ziegen) Antikörper gegen Kaninchen-Antikörper zu erzeugen, diese dann in großen Mengen zu gewinnen und sie mit dem Fluoreszenzfarbstoff zu markieren. Man spricht hier von indirekter Immunfluoreszenz. Warum dieser Umweg?
Ziegen-anti-Kaninchen-Antikörper können gegen jeden beliebigen in Kaninchen erzeugten Antikörper verwendet werden.
Von den spezifischen Kaninchen-Antikörpern stehen meist nur geringe Mengen zur Verfügung. Vielfach werden parallel eine Anzahl von Kaninchen mit unterschiedlichen Antigenen immunisiert. Man müßte demnach jeden der produzierten Antikörper getrennt mit dem Fluoreszenzfarbstoff markieren.
Man erhält eine Amplifikation, eine Verstärkung der Fluoreszenz, weil mehrere Ziegen-Antikörper von einem Kaninchen-Antikörpermolekül gebunden werden.
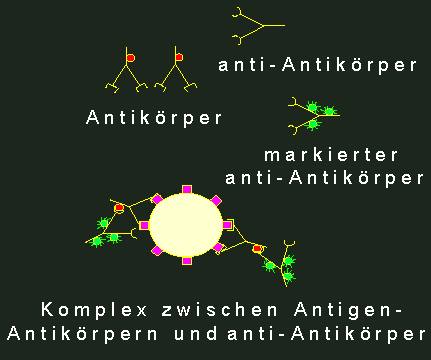
Indirekte Immunfluoreszenz. l. Spezifische Antikörper gegen das primäre Antigen. Die Antikörper selbst tragen antigene Determinanten (durch rote Kreise markiert). Normalerweise stellt man Antikörper dieser Art in Kaninchen her. 2. anti-Antikörper (hergestellt z.B. durch Immunisierung einer Ziege mit Kaninchenantikörpern). Diese anti-Antikörper (Ziege gegen Kaninchen) binden an antigene Determinanten des Kaninchenantikörpers. Wenn man sie vorher mit einem Fluoreszenzmarker (grün) versehen hat (3), erhält man am primären Antigen einen fluoreszierenden Komplex (4).
Für elektronenmikroskopische Untersuchungen verwendet man auch hier wieder elektronendichte Marker, mit denen die Ziegen-anti-Kaninchen-Antikörper versehen werden.
So umfangreich der Einsatz von Antikörpern in der medizinischen Forschung auch ist, so spärlich sind die Anwendungen bisher zum Studium von Pflanzenzellen. Einer der Gründe dafür ist die Zellwand, die von keinem Antikörper durchdrungen wird, zum anderen der Mangel an geeigneten Antigenen. Dennoch gibt es vorzeigbare Ergebnisse. Das Phytochrom, ein Rezeptor für Licht, das zu den wichtigsten Kontrolleinheiten in Pflanzenzellen gehört, konnte in bestimmten Zellen lokalisiert werden; es konnte aber auch gezeigt werden, daß es in anderen fehlt.
Zur Markierung von Zellinhalten müssen die Zellen entweder angeschnitten werden (z. B. Herstellung von Gefrierschnitten), oder es müssen Protoplasten erzeugt werden, deren Membran partiell durchlässig ist. Zu den weiteren durch Immunfluoreszenz lokalisierten Antigenen gehören u.a. einige Enzyme wie die Phosphoenolpyruvatcarboxylase, die alpha-Amylase sowie einige der Speicherproteine und der Elemente des Cytoskeletts.
Seit der Entdeckung durch C. MILSTEIN und G. KÖHLER (Medical Research Council, Laboratory of Molecular Biology, Cambridge und Basel Institute of Immunology) im Jahre 1975, werden die sogenannten monoklonalen Antikörper als Non plus ultra gehandhabt. Es sind homogene Antikörperpopulationen, die in Zellkultur produziert werden und die ein sehr enges Spezifitätsspektrum aufweisen (nur gegen eine Determinante gerichtet). Zu ihrer Herstellung: Es muß vorab noch gesagt werden, daß Antikörper in kleinen Lymphozyten produziert werden. Eines der lymphozytenreichsten Gewebe ist die Milz. Man immunisiert nunmehr - wie gehabt - z.B. eine Maus und entfernt ihr nach einigen Tagen die Milz, zerkleinert sie und gewinnt somit eine Zellsuspension. Diese Zellen werden mit Myelomzellen der Maus (einer von vielen Tumorzellinien) fusioniert. Durch die Fusion entsteht eine Hybridzelle (ein Hybridom). Myelomzellen zeichnen sich durch uneingeschränktes Wachstum aus; diese Eigenschaft bleibt auch in den Hybridomzellen erhalten. Hinzu kommt deren Eigenart, Antikörper zu bilden und zu sezernieren. Es bedarf eines zwischengeschalteten Selektionsschrittes, um eine gewünschte Zellinie zu isolieren und sie dann in Kultur zu nehmen.
Der Nachteil des Verfahrens: Die Antikörper sind zwar hochspezifisch, aber die Zahl der Bindungsstellen (Antigene) in den Zellen ist entsprechend verringert. Es werden daher nur sehr wenige Antikörpermoleküle gebunden, oft liegt die Antigen-Antikörper-Reaktion deshalb an der Grenze der Nachweisbarkeit. Aber auch hier sind Wege vorgezeichnet, um zum Erfolg zu gelangen: Im Falle der indirekten Immunfluoreszenz bedient man sich TV-Kameras mit elektronischer Restlichtverstärkung.
Lokalisierung von Enzymaktivitäten. Lassen sich Enzyme oder Substrate in der Zelle auch ohne den Aufwand mit den Antikörpern lokalisieren?
Auch hier gibt es verschiedene Ansätze. Am gebräuchlichsten ist die Autoradiographie. Man benötigt ein radioaktiv markiertes Substrat, besser ein Substratanaloges, das zwar vom Enzym gebunden, von ihm aber nicht umgesetzt wird. Nach dem Auswaschen von nichtgebundenem Material kann durch Auftragen eines Spezialfilms auf die Zelle ein Autoradiogramm hergestellt werden, aus dem die Position der Enzyme ersichtlich ist. Das Verfahren wird vornehmlich bei membrangebundenen Enzymen eingesetzt.
Eine andere Möglichkeit ist die Verwendung eines Substrates, das umgesetzt wird und als Produkt ein - möglichst unlösliches - farbiges Produkt ergibt; für die Elektronenmikroskopie verwendet man auch hier wieder elektronendichte Marker.
|
|